OBJETIVOS: DAR A CONOCER... ☺EN QUE CONSISTE LA TEORÍA CINÉTICA DE LA MATERIA. ☺LOS POSTULADOS EN QUE SE BASAN DICHAS TEORÍAS. ☺MENCIONAR A LOS CIENTÍFICOS DE ESTAS TEORÍAS, AL IGUAL QUE LAS DEDUCCIONES QUE SE PLANTEARON.
viernes, 13 de enero de 2017
jueves, 12 de enero de 2017
Aplicaciones y experimento
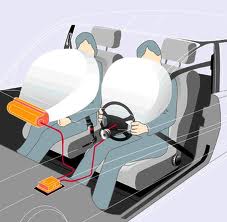 |
| Bolsa de aire |
Aplicación de las leyes de los gases
Las leyes de los gases se encuentran presenten en nuestra vida cotidiana. En cada una de las leyes podemos encontrar sus aplicación en lo que nos rodea.
Ley de Charles.
Esta ley nos dice “el volumen que ocupa una cantidad de gas es directamente proporcional a la temperatura absoluta”
1. Bolsas de aire: que establece que el volumen es directamente proporcional a la temperatura para encender la mezcla de gasolina y de aire que infla la bolsa de aire en menos de un segundo.Bolsa de Aire
Ley de Boyle
Esta ley nos dice que el volumen es inversamente proporcional a la presión: Si la presión aumenta, el volumen disminuye.
1. El aire entra en los pulmones porque la presión interna de estos es inferior a la atmósfera y por lo tanto existe un gradiente de presión. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presión superior a la atmósfera.
Ley de Avogadro
Volúmenes iguales de gases distintos a la misma temperatura y presión contienen la misma cantidad de moléculas.
Ley de Gay Lusaac.
Un ejemplo de aplicación para esta ley es la olla a presión porque el recipiente de una olla a presión tiene un volumen definido, si se aumenta la temperatura, la presión interna del recipiente aumenta.
Experimento de Ley de Gay Lusaac
Referencias bibliográficas
Jerry D. Wilson & Anthony J. Buffa . (2003 ). Física . México: PEARSON EDUCACION .
Paul G. Hewitt. (2007). Física conceptual . México: PEARSON EDUCACION .
Dolciani, D. Física, principios con aplicaciones. México. Prentice Hall.
March, Robert, H. Física para poetas. México: Siglo XXI, 1988.
Dolciani, D. Física, principios con aplicaciones. México. Prentice Hall.
March, Robert, H. Física para poetas. México: Siglo XXI, 1988.
martes, 3 de enero de 2017
Ley General
de los Gases
La Ley General de los Gases consiste en la unión de las siguientes leyes:
- · Ley de Boyle: P1 · V1 = P2 · V2
- · Ley de Gay-Lussac: P1 / T1 = P2 / T2
- · Ley de Charles: V1 / T1 = V2 / T2
Todas ellas se condensan en la siguiente fórmula que es
aplicable para una misma cantidad de gas:
P1 · V1 /
T1 = P2 · V2 / T2
Donde:
P= presión
V= volumen
T= temperatura absoluta (Kelvin)
Ejemplo:
Un gas tiene una presión de 600 mmHg, un volumen de 670 ml y
una temperatura de 100ºC. Calcular su presión a 200ºC en un volumen de 1,5
litros.
Solución: tenemos masa constante de gas por lo que podemos
aplicar la Ley General de los Gases: P1 · V1 / T1 = P2 · V2 / T2
Donde:
P1 = 650 mmHg
V1 = 670 ml = 0,67 litros
T1 = 100ºC = 373ºK
P2 = ?
V2 = 1,5 litros
T2 = 200ºC = 473ºK
Despejamos P2 :
P2 = (P1 · V1 / T1 ) · (T2 / V2)
P2 = (650 · 0,67 / 373) · (473 / 1,5) = 368 mmHg
Suscribirse a:
Comentarios (Atom)