Teoría cinética de la materia.
OBJETIVOS: DAR A CONOCER... ☺EN QUE CONSISTE LA TEORÍA CINÉTICA DE LA MATERIA. ☺LOS POSTULADOS EN QUE SE BASAN DICHAS TEORÍAS. ☺MENCIONAR A LOS CIENTÍFICOS DE ESTAS TEORÍAS, AL IGUAL QUE LAS DEDUCCIONES QUE SE PLANTEARON.
viernes, 13 de enero de 2017
jueves, 12 de enero de 2017
Aplicaciones y experimento
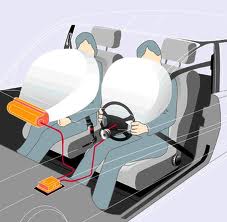 |
| Bolsa de aire |
Aplicación de las leyes de los gases
Las leyes de los gases se encuentran presenten en nuestra vida cotidiana. En cada una de las leyes podemos encontrar sus aplicación en lo que nos rodea.
Ley de Charles.
Esta ley nos dice “el volumen que ocupa una cantidad de gas es directamente proporcional a la temperatura absoluta”
1. Bolsas de aire: que establece que el volumen es directamente proporcional a la temperatura para encender la mezcla de gasolina y de aire que infla la bolsa de aire en menos de un segundo.Bolsa de Aire
Ley de Boyle
Esta ley nos dice que el volumen es inversamente proporcional a la presión: Si la presión aumenta, el volumen disminuye.
1. El aire entra en los pulmones porque la presión interna de estos es inferior a la atmósfera y por lo tanto existe un gradiente de presión. Inversamente, el aire es expulsado de los pulmones cuando estos ejercen sobre el aire contenido una presión superior a la atmósfera.
Ley de Avogadro
Volúmenes iguales de gases distintos a la misma temperatura y presión contienen la misma cantidad de moléculas.
Ley de Gay Lusaac.
Un ejemplo de aplicación para esta ley es la olla a presión porque el recipiente de una olla a presión tiene un volumen definido, si se aumenta la temperatura, la presión interna del recipiente aumenta.
Experimento de Ley de Gay Lusaac
Referencias bibliográficas
Jerry D. Wilson & Anthony J. Buffa . (2003 ). Física . México: PEARSON EDUCACION .
Paul G. Hewitt. (2007). Física conceptual . México: PEARSON EDUCACION .
Dolciani, D. Física, principios con aplicaciones. México. Prentice Hall.
March, Robert, H. Física para poetas. México: Siglo XXI, 1988.
Dolciani, D. Física, principios con aplicaciones. México. Prentice Hall.
March, Robert, H. Física para poetas. México: Siglo XXI, 1988.
martes, 3 de enero de 2017
Ley General
de los Gases
La Ley General de los Gases consiste en la unión de las siguientes leyes:
- · Ley de Boyle: P1 · V1 = P2 · V2
- · Ley de Gay-Lussac: P1 / T1 = P2 / T2
- · Ley de Charles: V1 / T1 = V2 / T2
Todas ellas se condensan en la siguiente fórmula que es
aplicable para una misma cantidad de gas:
P1 · V1 /
T1 = P2 · V2 / T2
Donde:
P= presión
V= volumen
T= temperatura absoluta (Kelvin)
Ejemplo:
Un gas tiene una presión de 600 mmHg, un volumen de 670 ml y
una temperatura de 100ºC. Calcular su presión a 200ºC en un volumen de 1,5
litros.
Solución: tenemos masa constante de gas por lo que podemos
aplicar la Ley General de los Gases: P1 · V1 / T1 = P2 · V2 / T2
Donde:
P1 = 650 mmHg
V1 = 670 ml = 0,67 litros
T1 = 100ºC = 373ºK
P2 = ?
V2 = 1,5 litros
T2 = 200ºC = 473ºK
Despejamos P2 :
P2 = (P1 · V1 / T1 ) · (T2 / V2)
P2 = (650 · 0,67 / 373) · (473 / 1,5) = 368 mmHg
sábado, 24 de diciembre de 2016
DEDUCCION DE LAS LEYES DE LOS GASES APARTIR DE LA TEORÍA.
Si vemos las moléculas de una muestra de gas como partículas
que chocan, podremos aplicar las leyes de la mecánica a cada molécula de ese
gas. Entonces, deberemos poder describir las características microscópicas de
ese gas, como presión, energía interna, etc., en términos del movimiento de las
moléculas. Sin embargo, debido al gran número de partículas que intervienen, se
utiliza un enfoque estadístico para tal descripción microscópica.
Uno de los mayores logros de la física teórica fue hacer
precisamente eso: deducir la ley de los gases ideales a partir de principios de
mecánica. Esta deducción dio pie a una nueva interpretación de la temperatura
en términos de la energía cinética translacional de las moléculas de gas. Como
punto de partida teórico, vemos las moléculas de gas como masas puntuales en
movimiento aleatorio, separadas por distancias relativamente grandes.
Según la teoría cinética de los gases, las moléculas de un
gas tienen choques perfectamente elásticos con las paredes de su recipiente.
Por las leyes del movimiento de Newton, es posible calcular la fuerza ejercida
sobre las paredes del recipiente a partir del cambio de cantidad de movimiento
de las moléculas de gas cuando chocan con las paredes.
 |
| Cruz D. (2016) Ilustración: Teoría cinética de los gases. Recuperado de: el libro de Física Jerry D. Wilson & Anthony J. Buffa . (2003 ). Física . México: PEARSON EDUCACION |
 |
| Devia. L. (2008) Ilustración: Teoría Cinética. Recuperado dehttps://sites.google.com /site/matiasncortez1/gases |
Si expresamos esta fuerza en términos de presión (fuerza/área),
obtenemos la ecuación siguiente:
Los supuestos básicos para obtener esta ecuación son:
- Todas las moléculas de un gas puro tienen la misma masa (m) y están en movimiento continuo y totalmente aleatorio. (La masa de cada molécula es tan pequeña que el efecto de gravedad sobre ella es insignificante).
- Las moléculas de gas están separadas por grandes distancias y ocupan un volumen insignificante en comparación con esas distancias.
- Las moléculas no ejercen fuerzas unas sobre otras, excepto cuando chocan.
- Los choques de las moléculas entre sí y con las paredes del recipiente son perfectamente elásticas.
Si despejamos, pV de la ecuación:
E igualamos la ecuación resultante
a la ecuación:
Veremos cómo es que la temperatura se interpreta como una medida de la energía cinética translacional:
Veremos cómo es que la temperatura se interpreta como una medida de la energía cinética translacional:
 |
| (para todos los gases ideales) |
Primera ley (Boyle)
Ley de Boyle-Mariotte (o Ley de Boyle), formulada por
Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que
relaciona el volumen y la presión de una cierta cantidad de gas mantenida a
temperatura constante. La ley dice que el volumen es inversamente proporcional
a la presión: PV=k
Cuando aumenta la presión, el volumen disminuye, mientras
que si la presión disminuye el volumen aumenta.
| Por Johann Kerseboom Ilustración Robert Boyle, recuperado de http://www.thefamouspeople.com/profiles/robert-boyle-5101.php |
Segunda ley (Charles)
El francés Jacques Charles descubrió que cuando la presión
no es demasiado elevada y se mantiene constante, el volumen de un gas aumenta a
la temperatura casi constante. Esto deduce que si un gas llega a enfriarse a
-273°C tendría un volumen 0 y a temperaturas aún más bajas su volumen tendría a
negativo, lo cual no tiene sentido. A esta temperatura se le llamó cero
absolutos de temperatura y es la base de la escala kelvin, que se utiliza para
trabajo científico.
Por lo tanto la ley de Charles nos dice: el volumen de una
cantidad dada de gas es directamente proporcional a la temperatura absoluta
cuando la presión se mantiene constante.
V/T=K
Por lo tanto al establecer un cambio en el volumen y
temperatura de un gas, la ley podría establecer también como:
V1/T1=V2/T2
| Ilustración Jaques Charles Recuperado de la pagina http://www.assemblee-nationale.fr/ |
Tercera ley (Gay-Lussac)
La tercera ley se llama Ley de Gay-Lussac en honor a
Joseph-Lussac. Dice lo siguiente: A un volumen constante, la presión absoluta
de un gas es directamente proporcional a la temperatura absoluta.
P/T=K
Si hay un cambio en la temperatura y la presión a un volumen
constante del gas podría obtenerse la siguiente ecuación cumpliendo la ley:
P1/T1=P2/T2
| Contributor: bilwissedition Ltd. & Co. KG Ilustración Joseph Louis Gay Lussac Recuperado de la pagina http://www.alamy.com/stock-photo- joseph-louis-gay-lussac-49831889.html |
miércoles, 21 de diciembre de 2016
Movimiento Browniano
Partículas
de polen los causantes de una teoría atómica…
A
principios del siglo XIX el botánico escoses Robert Brown había observado moléculas
de polen colocados en agua, que poseían
movimiento; dicho movimiento fue atribuido a fenómenos biológicos.
Pero
al descubrir que una gota de agua resguardada en una roca ígnea. La gota debió
haber permanecido in admisible ahí durante siglos al polen y otras partículas. En
el momento en que colocó Brown la gota de agua bajo el microscopio observo como
miles de partículas minúsculas se encontraban suspendidas en ella, estas tenían
un movimiento irregular, fenómeno que le pareció familiar a Brown en los
experimentos que realizaba con partículas de polen suspendidas en agua. Fue entonces
como Brown llego a la conclusión que la agitación de las partículas atrapadas
en una roca debía ser un fenómeno físico y no biológico, pero no desarrollo la teoría
con precisión.
Podemos
definir por lo consiguiente que el Movimiento Browniano es, un fenómeno de
movimiento aleatorio de partículas microscópicas que se encuentran suspendidas
en un medio fluido. Un ejemplo ya mencionado es el polen en una gota de agua.
Relación con la teoría cinética.
Durante
el siglo XIX los científicos tenían la creencia que el movimiento se debía a un
efecto de corrientes térmicas locales debidas a diferencia de temperaturas en
los fluidos pero estas teorías no tenían fundamento.
Sabían que cuanto más pequeña fuera la
partícula, más rápido era el desarrollo del movimiento y el aumento de la
temperatura incrementaba el movimiento de las partículas esta teoría tenía una relación
con la teoría cinética de los gases.
domingo, 4 de diciembre de 2016
TEMPERATURA
Es una magnitud física que refleja la cantidad de calor, ya sea de un cuerpo, objeto o del ambiente, que puede ser medida a través de un termómetro.
Al recordar la ecuación de la presión conocemos que la presión de un gas depende de su energía cinética.
La Ley de los Gases nos dice que la presión es proporcional a la temperatura.

Uno de los postulados nos dice:
-La energía molecular promedio es proporcional a la temperatura-

Una de las relaciones es la constante de Boltzmann (que relaciona la temperatura con la energía) está incluida en ésta proporcionalidad.
C. BOLTZMANN.

La constante de Boltzmann, es 3/2 de dicha proporcionalidad, que a su vez es el cociente entre la constante de los gases, entre el número de Avogrado ( número de átomos, electrones, iones o moléculas que existen en un mol de una sustancia cualquiera),
NA = 6,022 141 29(27)×1023
Ésta relación nos permite deducir el Teoréma de Equipartición de la energia (relaciona la temperatura de un sistema de su energía media).
La energía cinética en K es:
12,47 J en un mol
En condiciones estándar de presión y temperatura se obtiene que la ENERGÍA CINÉTICA total de un gas es:
3406 J en un mol
5,65 zJ en una molécula
Suscribirse a:
Comentarios (Atom)






